2024年9月20日至9月22日,第十一届海峡两岸医药卫生交流协会风湿免疫病学专业委员会学术年会在昆明圆满召开。此次大会吸引了来自海峡两岸的众多专家学者,共同探讨了风湿免疫病学领域的最新研究成果和临床实践,进一步促进了多学科规范化综合治疗的发展。

图1第十一届海峡两岸医药卫生交流协会风湿免疫病学专业委员会学术年会
类风湿关节炎(RA)是一种以侵蚀性关节炎症为主要临床表现的自身免疫性疾病病,具有高复发性、高致残性,以甲氨蝶呤(MTX)为代表的传统改善病情抗风湿药(DMARDs)是RA的一线治疗药物[1],但部分患者对其反应不佳或不耐受,亟需新型有效的抗风湿药物填补治疗上的欠缺。泰它西普是由我国自主研发的创新性双靶点生物制剂,在RA及其他自身免疫性疾病患者中展现出良好的疗效和安全性。9月21日下午,泰它西普全新机制靶向B细胞治疗RA解读发布仪式正式启动,随后由北京协和医院风湿免疫科李梦涛教授以《泰它西普——RA合并其他自身免疫性疾病的治疗新突破》为主题展开精彩分享,赢得了与会者的高度评价和热烈讨论。
泰它西普获批RA适应证,为RA患者提供治疗新选择
目前中国RA约有500万患病人群,呈现患病多、病程长、中重度患者多、并发症多的“四多”特点[2],不仅严重影响患者的身体功能和生活质量,还给家庭和社会带来沉重经济负担。近年来,随着生物或靶向合成DMARDs的广泛应用,RA患者的临床缓解率明显改善,但是仍有不少患者最终残疾。因此,对于该类患者,如何控制疾病稳定、避免或延缓残疾是临床亟需解决的难题。研究显示,该类患者使用B细胞通路疗法可能更有效,而泰它西普作为靶向B细胞通路的全新机制药物,可显著降低自身抗体水平,对系统性红斑狼疮(SLE)、类风湿关节炎(RA)、干燥综合征(SS)、IGA肾病(IgAN)等多种自身免疫性疾病均有疗效。
2024年7月16日,中国国家药品监督管理局(NMPA)批准泰它西普与甲氨蝶呤(MTX)联合用于对MTX疗效不佳的中重度活动性RA成人患者,这是泰它西普继SLE后,在中国获批的第2个适应证,也是截至目前全球唯一获批治疗RA的双靶三通路生物制剂。该适应证的获批不仅标志着泰它西普在RA治疗领域取得重要进展,也为广大RA患者带来了新希望。

图2 泰它西普全新机制靶向B细胞治疗RA解读发布仪式专家合影
双靶生物制剂泰它西普——RA合并其他自身免疫性疾病的治疗新突破
在本次会议上,北京协和医院风湿免疫科李梦涛教授带来了题为《RA合并其他自身免疫性疾病的治疗新突破》的学术报告,详细介绍了双靶生物制剂泰它西普在RA领域最新研究成果和临床应用前景,为该领域的发展提供了宝贵的学术贡献。
图2 李梦涛教授专题分享
李梦涛教授指出,临床需要重视RA合并其他自身免疫性疾病这一RA亚型,因为这类患者关节侵蚀更严重,更易发生关节外症状,死亡风险更高[3-4]。据统计,高达20%的中国RA患者合并其他自身免疫性疾病[5],如SLE、SS、自身免疫性肝炎(AIH)、原发性胆汁性胆管炎(PBC)等,并且随着RA病程的延长,合并其他自身免疫性疾病的风险显著增加。研究显示,RA合并SLE的发生率为3.6%-9.7%,与单纯RA患者相比,合并SLE的RA患者自身抗体阳性率高,关节侵蚀更严重,死亡率增加约4.5倍[4,6-8]。RA合并SS的发生率为32.1%,合并SS的RA患者疾病活动度更高、影像学进展更迅速,更难达标[3,9-11]。在RA中,合并AIH的发生率为1.3%[12],进一步增加了患者的死亡风险。目前RA患者合并其他自身免疫病仍然缺乏有效治疗方案,2022年《类风湿关节炎诊疗规范》推荐酌情根据受累部位、严重程度予以个体化糖皮质激素治疗,但激素副作用大,临床亟需新的安全、有效的治疗药物[1]。
近年来,研究发现自身免疫性疾病存在相似的发病模式,而B细胞及其产生的自身抗体在RA、SLE、SS、AIH等自身免疫性疾病的发生发展中具有关键作用[13-16]。作为B细胞通路的关键因子,BLyS和APRIL在多种自身免疫性疾病(如RA、SLE、SS等)中表达升高。机制研究发现,BLyS水平越高,RA疾病活动度越高,骨质破坏越严重,而APRIL可促进滑膜成纤维细胞(FLS)的增殖和侵袭参与RA发生发展,针对BLyS和APRIL受体TACI的重组蛋白可通过抑制APRIL减弱APRIL对FLS的刺激作用[17-18]。泰它西普是由TACI(BLyS和APRIL受体)蛋白的功能区段与IgG的Fc段构成的重组蛋白,可以同时阻断BLyS和APRIL,抑制自身反应性B细胞成熟分化、减少浆细胞自身抗体分泌,从而更好地控制疾病活动,延缓疾病进展[19-21]。
泰它西普获批RA适应证主要基于一项随机、双盲、安慰剂对照、开放标签的III期临床研究[22]。该研究纳入479例对MTX应答不足的中重度RA患者,患者以3:1比例随机接受泰它西普160mg或安慰剂治疗24周,随访至48周。研究的主要终点为第24周ACR20应答率,次要终点为第48周ACR20应答率、第24周/48周ACR50应答率、ACR70应答率、DAS28-ESR评分<2.6和≤3.2的患者比例以及无影像学进展(mTSS)、健康评估问卷(HAQ)等变化情况。结果显示,自第4周起,泰它西普即可提升RA患者的ACR20应答率,24周和48周时ACR20应答率分别为67.4%、72.2%,ACR50应答率也由24周的24.2%提升至48周的43.7%(图1)。对比不同靶向DMARDs治疗MTX应答不足RA患者的疗效数据(非头对头)发现,泰它西普在ACR20/50/70应答率方面不弱于阿达木单抗、托珠单抗、托法替布等药物。此外,与安慰剂相比,泰它西普可显著降低肿胀关节数、延缓关节结构损害,分别有92.8%和89.9%的患者在24周和48周时无影像学进展(图2)。在安慰剂转为泰它西普治疗的患者中观察到类似获益。在安全性方面,泰它西普治疗组和安慰剂组不良事件的发生率相似,且未增加受试者的感染风险,表明泰它西普在RA患者中具有较好的安全性和耐受性。
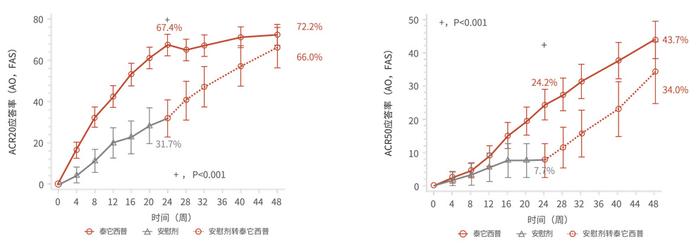
图4 不同治疗组ACR20、ACR50反应率随时间的变化
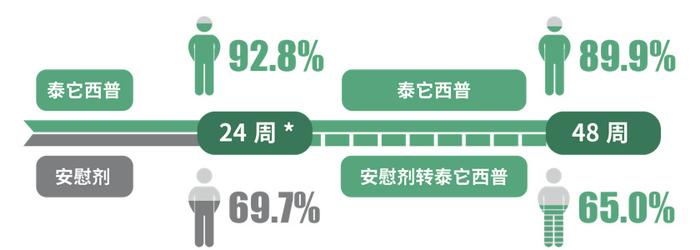
图5 无影像学无进展(△mTSS≤0)的患者比例
一项纳入335例活动性SLE患者的双盲、安慰剂对照、多中心III期研究评估了泰它西普在SLE患者中的疗效[23],结果显示,从第4周起,泰它西普组SRI-4应答率显著高于安慰剂组,52周SRI4应答率达82.6%(图3)。由于自身免疫反应,SLE患者会消耗大量补体,导致补体水平下降。该研究显示,泰它西普组补体C3、C4水平自第4周显著上升且持续至52周,52周时,与基线变化率相比,泰它西普组补体C3(28.39% vs 11.51%)、C4水平(66.64% vs 8.35%)均显著高于安慰剂组。这些数据提示泰它西普可快速发挥作用,且可维持疗效。
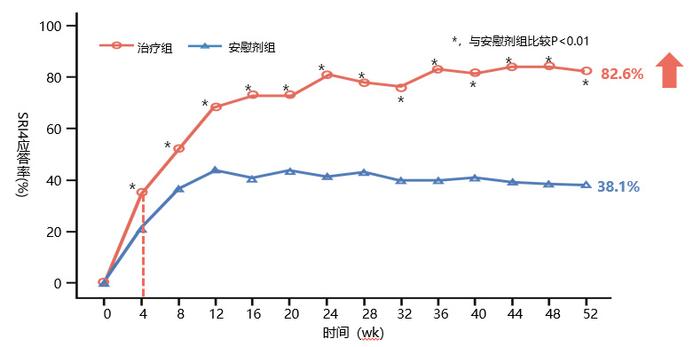
图6 SRI4应答率随时间的变化
泰它西普治原发性干燥综合征(pSS),同样具有疗效。一项纳入42例pSS受试者的随机双盲、安慰剂对照、多中心Ⅱ期临床研究显示泰它西普可快速、持续改善免疫球蛋白水平,显著降低ESSDAI评分,治疗24周,泰它西普160mg组IgG水平较基线降幅达约24%,ESSDAI评分较基线降低4.3分[24]。此外,已有研究显示B细胞靶向疗法可清除自身反应性B细胞,防止肝细胞损伤,改善肝酶和胆红素水平,减少激素用量,延缓复发,且无药物相关严重不良反应发生,在AIH中具有不错的治疗前景[25]。综上,泰它西普有望为RA合并其他自身免疫性疾病患者带来治疗新突破,不失为RA合并其他自身免疫性疾病患者的有效选择。
总结
目前我国RA整体诊疗现状并不乐观,致残率高达77.6%[26],临床亟需探索新的安全有效的治疗药物。泰它西普是我国自主研发的一种BLyS/APRIL双靶点融合蛋白创新药,在B细胞介导的多种自身免疫性疾病中表现出良好的治疗前景。此次泰它西普成功获批RA适应证无疑为风湿免疫科医生治疗RA提供了新利器,也为RA及合并其他自身免疫性疾病的患者提供了新的治疗选择。
参考文献:
[1] 耿研,谢希,王昱, 等. 类风湿关节炎诊疗规范. 中华内科杂志,2022,61(01):51-59.
[2] 曾小峰, 田新平, 李梦涛, 等. 中国类风湿关节炎发展报告2020. 沈阳:辽宁科学技术出版社, 2021:1-157.
[3] Brown LE, Frits ML, Iannaccone CK, et al. Rheumatology (Oxford). 2015 May;54(5):816-20.
[4] Frade-Sosa B, Narváez J, Salman-Monte TC, et al. Lupus. 2020 Sep;29(10):1216-1226.
[5] 蔡文心,李仕成,刘一鸣,等. 类风湿关节炎临床分层及其特征的横断面研究. 北京大学学报(医学版),2022,54(6):1068-1073.
[6] Amezcua-Guerra LM. J Rheumatol. 2009 Jan;36(1):4-6.
[7] Antonini L, Le Mauff B, Marcelli C, et al. Autoimmun Rev. 2020 Sep;19(9):102612.
[8] Icen M, Nicola PJ, Maradit-Kremers H, et al. J Rheumatol. 2009;36(1):50-57.
[9] Harrold LR, Shan Y, Rebello S, et al. Clin Rheumatol. 2020 Jun;39(6):1899-1905.
[10] He J, Ding Y, Feng M, et al. Rheumatology (Oxford). 2013;52(6):1084-1089.
[11] Zhang H, Zhang H, Gao D, et al. Arthritis Res Ther. 2020 May 1;22(1):100.
[12] Wang CR, Tsai HW. World J Gastroenterol. 2022 Jun 21;28(23):2527-2545.
[13] Deane KD, El-Gabalawy H. Nat Rev Rheumatol. 2014 Apr;10(4):212-28.
[14] Lee DSW, et al. Nat Rev Drug Discov. 2021 Mar;20(3):179-199.
[15] Mieli-Vergani G, Vergani D, Czaja AJ, et al. Nat Rev Dis Primers. 2018 Apr 12;4:18017.
[16] Nocturne G, et al. Nat Rev Rheumatol. 2013 Sep;9(9):544-56.
[17] Zhang LL, et al. Acta Pharmacol Sin. 2021 Oct;42(10):1665-1675.
[18] Chang Y,et al. Mol Immunol. 2015 Mar;64(1):90-8.
[19] Haselmayer P, et al. Eur J Immunol. 2017;47(6):1075-1085.
[20] Samy E, Wax S, Huard B, et al. Int Rev Immunol. 2017 Jan 2;36(1):3-19.
[21] Dillon SR, Gross JA, Ansell SM,et al. Nat Rev Drug Discov. 2006 Mar;5(3):235-46.
[22] Li Wang, Dong Xu, Jianmin Fang, et al. 2023ACR. L20.
[23] Di Wu, et al. 2023 EULAR.OP037.
[24] Xu D, Fang J, Zhang S, et al. Rheumatology (Oxford). 2024 Mar 1;63(3):698-705.
[25] Than NN, Hodson J, Schmidt-Martin D, et al. JHEP Rep. 2019 Nov 5;1(6):437-445.
[26] 栗占国. 倡导类风湿关节炎深度缓解:无致残可望可及. 中华内科杂志, 2024, 63(8): 731-733.


















